在医药行业,质量是生命线,QC 实验室则是这条生命线的关键守护者。随着法规监管趋严、数据量激增与行业竞争加剧,传统实验室管理模式难以为继,实验室信息管理系统(LIMS)成为推动医药生产 QC 实验室数字化转型的核心力量。
从法规政策层面来看,近年来医药行业法规持续完善,对实验室数据管理、流程规范提出严苛要求。《中华人民共和国药品管理法》强调药品全生命周期的信息可追溯性,《药品生产质量管理规范》及其系列附录,明确规定药企需采用信息化手段记录生产与检验数据。以疫苗和血液制品生产为例,法规强制要求通过信息化系统如实记录数据,确保生产全过程符合法定要求,这使得 LIMS 系统成为药企合规运营的必备工具。
LIMS 系统是基于计算机网络技术和数据库管理技术构建的智能化管理体系。它以实验室为核心,将人员、仪器设备、样品、方法、数据等关键要素有机整合,通过对业务流程的梳理和优化,牵翼云医药实验室板块LIMS 实现了从取样到合格判定全流程的标准化和自动化,提升检测准确性与效率。样品管理模块详细记录样品信息,自动跟踪流转状态,实现全生命周期可追溯。电子记录本(ELN)模板可视化配置,与 LIMS 无缝集成,自动计算、修约数据并支持电子签名与痕迹追溯,确保数据记录规范、可靠。
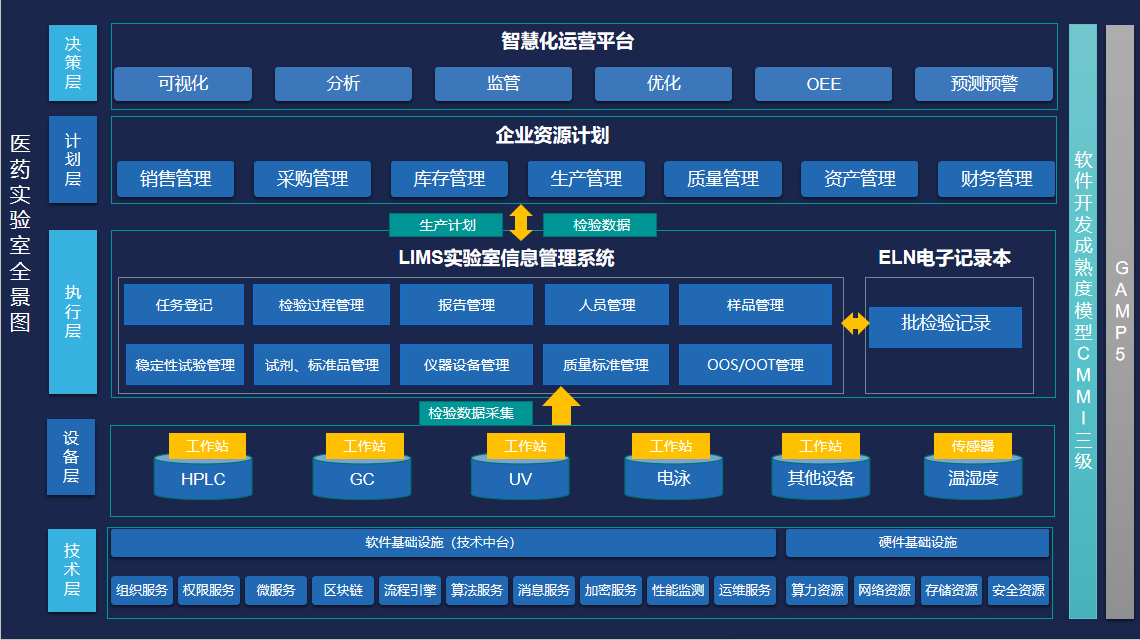
在数据管理方面,牵翼云医药实验室板块LIMS 具备强大的数据采集、存储和分析功能。它可与各类分析仪器无缝对接,实现自动采集仪器设备产生的检测数据,避免了人工录入可能出现的错误,保证了数据的准确性和完整性。同时,系统对海量数据进行分类存储,方便用户随时查询和调用。通过内置的数据分析工具,LIMS还能对数据进行深度挖掘,为质量控制和决策提供有力支持。例如,利用统计分析功能,可对产品质量进行趋势分析,及时发现潜在的质量问题并采取措施加以解决。
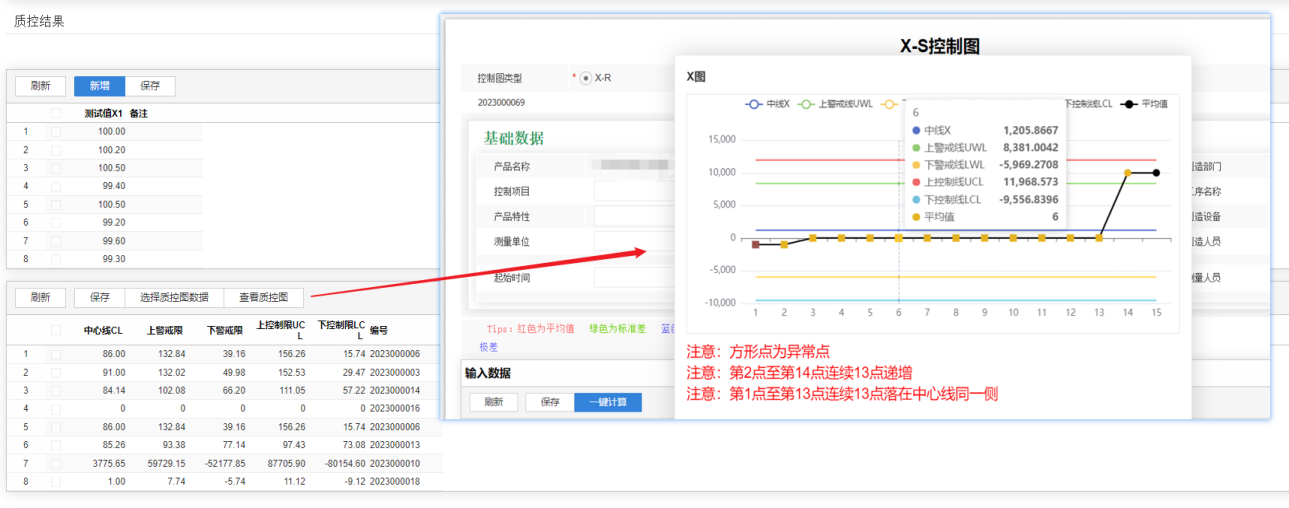
从实践角度出发,某知名药企引入牵翼云医药实验室板块LIMS后,实现了检测流程的优化。系统根据预设的检测方案,自动分配检测任务给相应的人员和设备,检测进度得到实时监控。原本需要数天才能完成的检测项目,如今通过 LIMS的高效调度,缩短至一天以内,大大提高了检测效率。同时,该系统强化了合规性管理,严格按照 FDA 21 CFR Part 11、GMP 等法规要求,对数据的生成、修改、审核等操作进行全程记录和审计追踪,确保了数据的可靠性和完整性,满足了监管部门的审查要求。
综上所述,牵翼云医药实验室板块LIMS在医药生产 QC 实验室中,从理论基础到实际应用,均展现出强大的优势和价值。通过对系统功能的深度运用,医药企业能够提升实验室管理水平,提高药品质量控制能力,在激烈的市场竞争中赢得先机。








